医疗器械指令涉及所有医疗器械,从无菌手套到电子监控设备和复杂的 MRI 扫描仪。指令 93/42/EEC 涵盖医疗器械在 CE 标志框架内的投放市场和投入使用。
医疗设备分为 I 类到 III 类,确定所需的合规性测试级别。
医疗器械的标记
医疗器械的标记受 EN 15223-1:2012 标准管辖。我们提供有助于标记您的设备的符号集。
设备类
医疗器械可分为 I 类、IIa 类、IIb 类和 III 类,III 类涵盖风险最高的产品。医疗器械根据两个标准进行分类,一个是侵入性级别,另一个是关于对患者的伴随风险级别。

您应该考虑的一些因素是:
旨在连续使用
侵入性或手术侵入性,
可植入的,
该设备是否包含某种物质。
医疗器械风险图
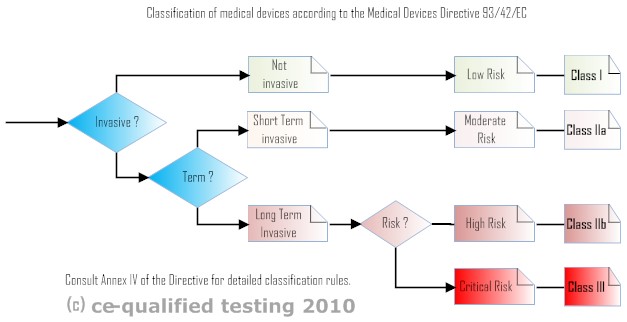
I类设备
I类:非侵入性低风险:不带监测功能的设备或装置。
I 类设备不是侵入性的,不应该给病人任何东西,药物或能量。
I 类医疗设备可以使用制造商声明 (类似于 LV 或 EMC 指令)获得批准,不需要任何认证或公告机构的参与。
IIa/b 类设备
II 类:非侵入性或短时间侵入性设备或密集的患者皮肤接触或施用体液或药液或气体。
II 类设备(及以上)需要指定机构的参与,该机构将批准客户文件和/或 QMS。
下图显示了作为设备类别功能可用的合格评定模块。
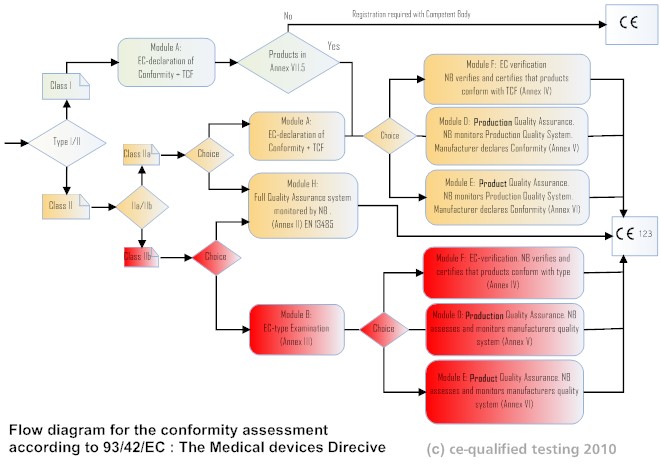
医疗器械合格评定
一般要求
实施质量管理体系
根据指令中的附件 II 或 V,医疗器械的设计和生产需要受到内部质量制造体系的控制(但属于 I 类)。许多公司选择应用“ISO 13485:医疗器械:质量管理体系”作为他们的主要质量体系。
详细要求
测试程序和判断通常由风险分析方法指导。
准备一份符合 EN 14971 的风险管理文件,
获得足够的临床数据以获得索赔证明,
创建生物安全证明,
符合EN 60601-1系列标准的电气安全要求,
符合电磁兼容性(EMC)EN 60601系列标准,
根据 EN 62304 为软件创建风险分析指导可靠性报告,
实施标签和说明要求和翻译,
维护批次或组件级别的可追溯性记录,
建立警戒制度。
医疗器械的合规性是一个持续的过程,在考虑报告的现场问题和事故的情况下,定期重复输入剩余风险列表(作为先前合规性分析的结论)关于改进设备以保持或实现“最先进”产品的观点。
准备技术施工文件
技术构造文件 (TCF) 是强制性的。必须创建和维护设备的完整构造细节以及为符合指令的基本要求而采取的所有措施。
对于除 I 类设备之外的所有设备,TCF 都需要公告机构的批准。
登记
I 类医疗器械需要在主管当局注册。
协调标准
医疗器械指令使用协调标准来表明符合指令基本要求的推定:
93/42/EC OJC 022 协调标准清单 2013-01-24(最新)
93/42/EC OJC 163 协调标准清单 2009-07-15
93/42/EC OJC 314 协调标准清单 2007-12-07
93/42/EC OJC 304 协调标准清单 2008-11-27
医疗设备的 EMC
医疗设备应符合 EN 60601-1-2:2006 和许多子部分中的几个。
医疗设备的电气安全
设备应符合 EN 60601-1:2007 和适用的子部分,具体取决于设备的类型。EN 60601-1 标准系列包含对患者接触电流、介电测试和单一故障要求的广泛要求。
ce-test 提供此标准的测试服务。
风险管理评估
对 ISO 14971:2007 的全面风险评估是医疗器械审批程序的一部分。可以根据 FMEA(故障模式和影响分析)和双向 TOP-DOWN-TOP FTA(故障树分析)方法进行此类风险评估。其他方法也是可以接受的。
可追溯性
产品需要完全可追溯,无论是在生产阶段(组件来自哪里)还是在营销阶段(产品卖给谁)。可以帮助您满足可追溯性的要求。
警觉
制造商需要建立和维护一个系统,以便将设备发生的事故和“近乎事故”充分报告给当局。结合产品所需的可追溯性,这将允许有效的产品召回,并在需要时减少对患者的附带损害。
上市后监督
制造商需要关注对产品安全性的任何可能改进 - 达到最先进水平 - 并尽快在最终产品中实施它们,即使在产品投放市场之后也是如此。剩余风险列表应作为此过程的输入。
标签
医疗设备需要贴上标签,以便目标客户可以安全使用。这包括一组针对常见危险的警告和标记,例如灭菌警告、使用日期和其他警告。ISO 15223:2007中定义了许多符号。本协调标准中的符号可在设备上使用,无需进一步的文字解释。
合规性测试
一直在进行多项医疗设备评估,包括 I 类和 II 类。我们成功评估的产品示例包括:
干式灭菌器(Ⅰ类)
触觉振动测试发生器(I 类)
触觉冷热测试发生器(I 类)
包括医疗警报的医院护士呼叫系统(IIb 类)
尿床报警器(IIa类)医用气体报警器(I类)
输液泵(IIa类)
临床手术椅
睡眠监测仪
我们很乐意根据MD指令为您提供适合您的设备型式测试的报价:在此处询问报价
非欧洲制造商
EC REP(欧洲授权代表)
作为非欧洲医疗器械制造商,您需要为您的产品设立一个EC授权代表。需要在您的产品上提及EAR (EC REP) 的名称。
欧共体授权代表
EC REP是您指定的协助合规流程的法律实体,在欧洲应被视为中立的合规合作伙伴。
它的主要职责是(除其他外):
联系当局,
协助产品分类,
对您的产品执行警戒功能,
保持合规文件可用,
根据国家主管部门的要求通知和注册产品,
EC 内的事件报告和投诉处理。


