助听器ce认证,检测报告,助听器CE认证办理流程?助听器CE认证周期,助听器CE认证标准,助听器CE认证流程,助听器CE认证资料,助听器CE认证如何办理,深圳CE认证,助听器CE检测,助听器CE认证报告,助听器CE认证证书,深圳助听器CE认证办理,电子电器CE认证,小家电CE认证,检测报告,欧盟CE认证。

助听器是什么
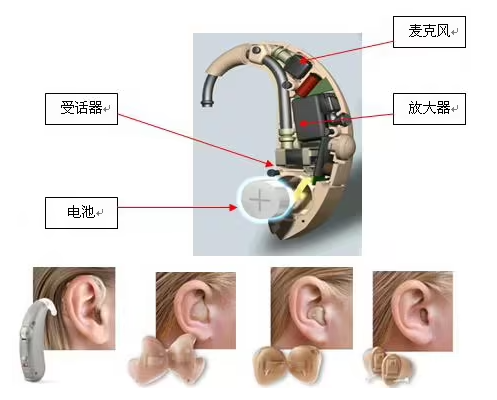
助听器是帮助提高听力的仪器,实际上就是一个小型的半导体扩音器,其作用可以使比较弱小的声音,经放大后传到耳机,使本来听力下降的部位借助放大作用而听到声音。有如下几种类型,但是作用和原理都是一样的。
(1)从外部结构可分为:盒式、耳背式、耳内式,而耳内式又可分成普通耳内式、耳道式、深耳道式。
(2)从电子原理可分为:模拟助听器;可编程助听器、全数码助听器、宽动态语言技术助听器等。
(3)助听器按传导方式分为气导助听器和骨导助听器。盒式、耳背式、耳内式都属于气导助听器。
医疗器械指令简介
有源植入医疗器械指令(EC-directive90/385/EEC 简称AIMD)
适用于心脏起搏器、可植入的胰岛素泵等,已于1993年1月1日生效,1995年1月1日强制实施。
医疗器械指令(EC-directive 93/42/EEC 简称MDD)
已于1995年1月1日生效,1998年6月14日强制实施,目前已升版为2007/47/EC。
体外诊断试剂指令(EC-Directive98/79/EC 简称IVDD)
适用于血细胞计数器、妊娠检测装置等,已于1998年12月7日生效,2003年12月7日强制实施。
93/42/EEC中的定义、范围
医疗器械:是指制造商预定用于人体以下目的的任何仪器、装置、器具、软件、材料或其他物品,无论它们是单独使用还是联合使用,包括独立用于诊断和治疗的软件:
——疾病的诊断、预防、监视、治疗或减轻
——损伤或残障的诊断、监视、治疗、减轻或修补
——解剖学和生理过程的探查、替换或变更
——妊娠的控制
医疗器械不是通过药理学、免疫学或代谢学作用等方式在人体内或人体上达到其预定的主要作用,但这些方式有助于其他功能的实现。
附件:本身虽然不是器械,但由其制造商专门指定与器械一起使用,使其能够按照制造商预定的器械用途来使用
制造商:是指在以其名义将器械投放市场前负责器械的设计、制造、包装和标签的自然人或法人,无论这些工作是自己完成的,还是由第三方代表他完成的。
预期用途:是指根据制造商在标签、说明书和或宣传材料中提供的资料对器械预期的用途。

什么是CE认证
“CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。CE代表欧洲统一。 在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。
助听器申请CE认证需提供资料
1. 2-3个测试样品;
2. 电路原理图;
3. 产品说明书或使用手册;
4. 申请表(实验室提供表格);
5. 零部件清单(BOM表);
6. PCB图(正反面)。
助听器CE认证办理流程:
1.填写申请表,
2.提供产品的资料,
3.寄样品,
4.测试OK,
5.出报告/证书
助听器CE认证测试周期
助听器办理周期5个工作日左右
以上为你介绍的就是助听器CE认证如何办理的相关事项,助听器CE认证多少钱具体可电询,受理助听器CE认证案件可以为客户加急。


